对乳腺肿瘤的认识可追溯到公元前。公元前 460 年~ 前 377 年,古希腊著名医生希波克拉底在其《文集》中对乳腺癌进行了详细描述,从而揭开了人类认识乳腺癌的历史。
自从于公元1 世纪,希腊 Leonides 医生首先发现乳头凹 陷是乳腺癌的一个重要体征,主张外科手术治疗乳 腺癌,并首先实施了乳腺肿块切除之后,乳腺癌的手术治疗便正式拉开了帷幕。
它先后经历了:
1、局限切除:仅切除肿块或乳腺;
2、局部广泛切除:切除范围包括胸肌及周围部分正常的组织;
3、 乳腺癌根治术----整块切除包括肿瘤在内的全部乳腺、相当范围的乳腺皮肤和周围组织,以及胸大、小肌和腋窝淋巴结;(乳腺癌根治术的诞生,开创了乳腺癌外科手术 史上的新纪元,使乳腺癌手术后局部复发率从 80% 降低到 20%左右,长期生存率明显提高,被誉为乳 腺癌手术的经典术式。)
4、扩大根治术阶段:1949 年及 1951年,Margottini 和Urban 分别提出根治术合并胸膜 外和胸膜内清除内乳淋巴结的乳腺癌扩大根治术。 1954年,Andreassen 和 Dahllverson 又在扩大根治术的 基础上加行锁骨上淋巴结清扫。 1956 年,Arhelger 等 甚至还要行纵隔淋巴结清扫,分别称之为超根治与扩大超根治术。 从而把乳腺癌的外科手术治疗推向 “超根治切除”的时代。
5、改良根治术:保留胸大、小肌的根治术;
6、保乳手术。
乳腺癌的手术治疗经历了由小到大,再由大到小的轮回。是在影像、放疗、化疗、内分泌治疗、靶向治疗等多学科诊断、治疗手段发展的基础上学科发展的必然结果和规律。
手术完成后不等于治疗的结束,根据不同的肿瘤分期,分子分型还需进行化疗、放疗、内分泌治疗,靶向治疗等。以下是手术后各种治疗选择的标准。
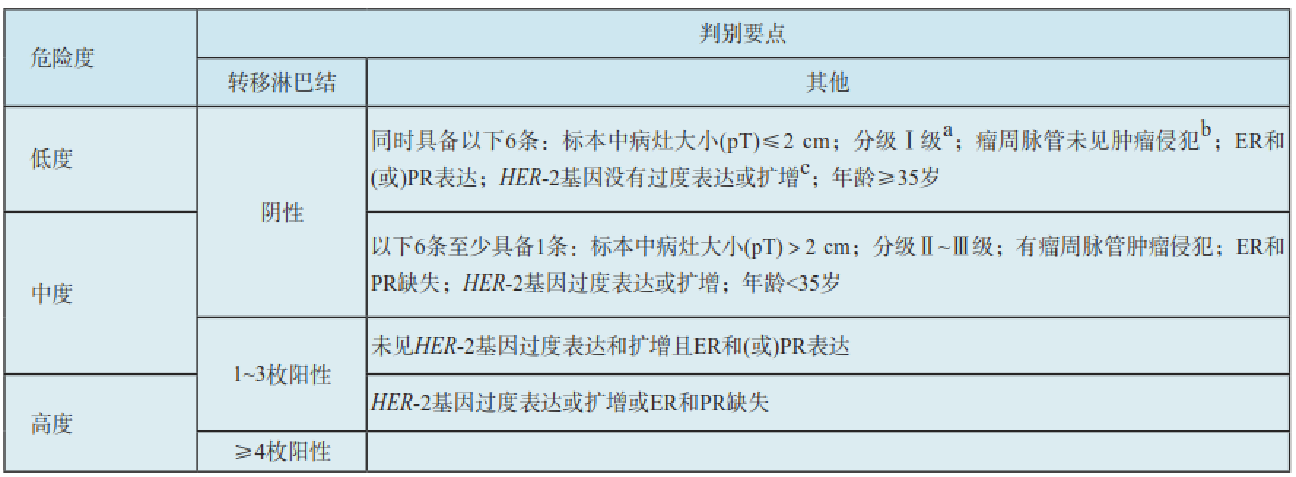
乳腺癌复发风险分组
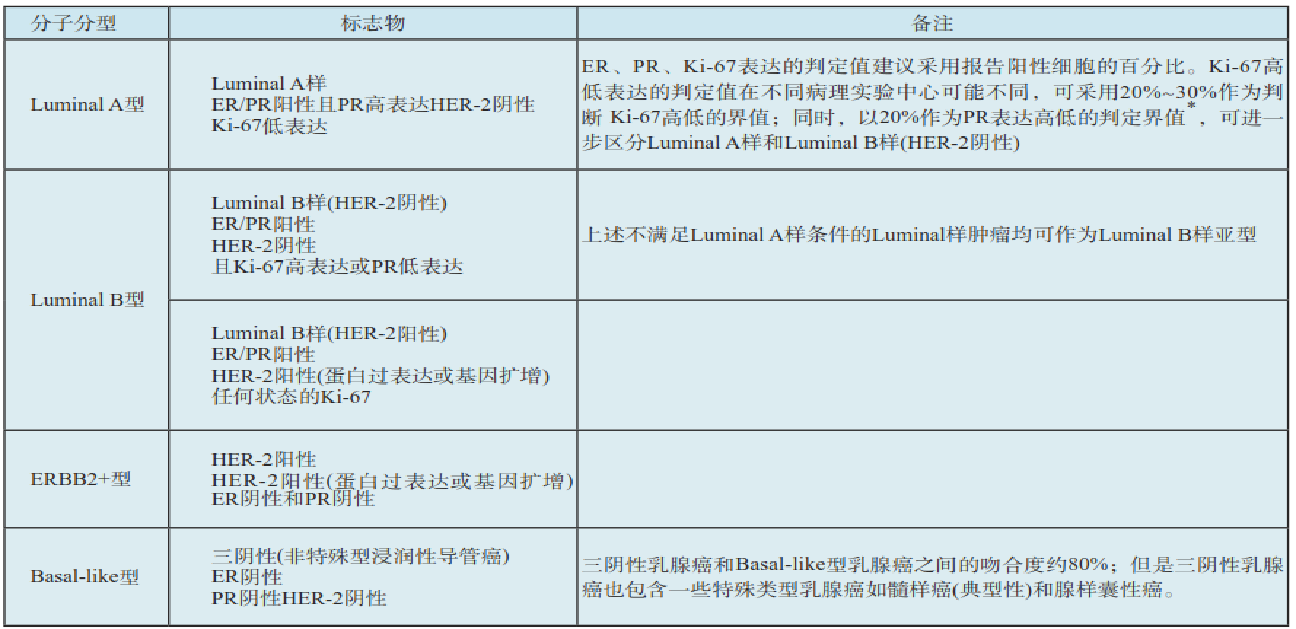
乳腺癌分子分型的标志物监测和判定
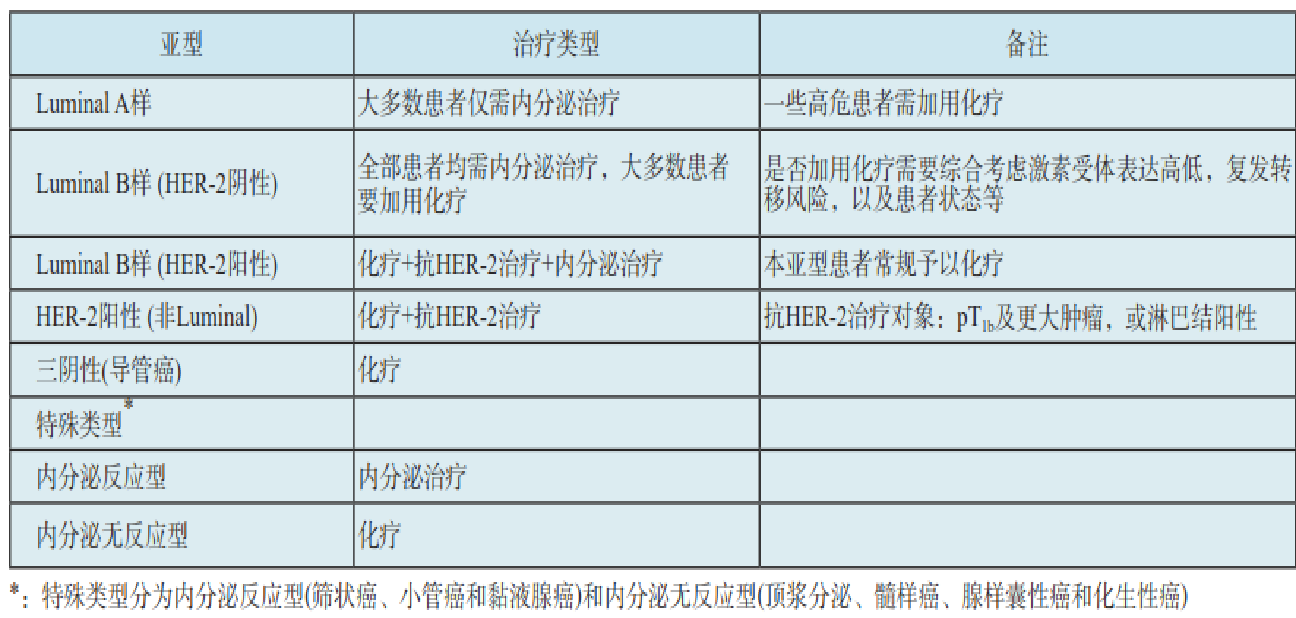
不同分子型的推荐治疗
乳腺癌术后辅助化疗适应证:
⑴ 浸润性肿瘤大于2 cm。
⑵ 淋巴结阳性。
⑶ 激素受体阴性。
⑷ HER-2阳性(对T1a以下患者目前无明确证据推荐使用辅助化疗)
⑸ 组织学分级为3级。
以上单个指标并非化疗的强制适应证,辅 助化疗方案的制定应综合考虑上述肿瘤的临床病理学特征、患者生理条件和基础疾患、患者 的意愿,以及化疗可能获益与由之带来的不良 反应等。免疫组织化学检测应该常规包括ER、 PR、HER-2和Ki-67。
禁忌证
⑴ 妊娠期:妊娠早、中期患者,应慎重选择化疗。
⑵ 年老体弱且伴有严重内脏器质性病变患者。
注意事项:
1、若无特殊情况,一般不建议减少化疗的周期数。
2、在门诊病历和住院病史中应当记录患者当时的身高、体质量及体表面积,并给出药物的每平方米体表面积的剂量强度。一般推荐首次给药剂量应按推荐剂量使用,若有特殊情况需调整时不得低于推荐剂量的85%,后续给药剂量应根据患者的具体情况和初始治疗后的不良反应,可以1次下调20%~25%。每个辅助化疗方案仅允许剂量下调2次
3、辅助化疗一般不与内分泌治疗或放疗同时进行,化疗结束后再开始内分泌治疗,放疗与内分泌治疗可先后或同时进行。
4、化疗时应注意化疗药物的给药顺序、输注时间和剂量强度,严格按照药品说明和配伍 禁忌使用。
5、激素受体阴性的绝经前患者,在辅助化疗期间可考虑使用卵巢功能抑制药物保护患者的卵巢功能。推荐化疗前1~2周给药,化疗结束后2周给予最后1剂药物。
6、蒽环类药物有心脏毒性,使用时须评估LVEF,至少每3个月1次。如果患者使用蒽环类药物期间发生有临床症状的心脏毒性,或无症状但LVEF<45%亦或较基线下降幅度超过15%,可考虑检测肌钙蛋白,必要时应先停药并充分评估患者的心脏功能,后续治疗应慎重。
7、中国专家团认为三阴性乳腺癌的优选化疗方案是含紫杉和蒽环的剂量密度方案。大多数Luminal B(HER-2阴性)乳腺癌患者需要接受术后辅助化疗,方案应包含蒽环类和(或)紫杉类药物。
乳腺癌术后辅助内分泌治疗:
适应症:激素受体ER和(或)PR阳性的乳腺癌患者。
内分泌治疗与其他辅助治疗的次序:辅助内分泌治疗与化疗同时应用可能会降低疗效。一般在化疗之后使用,但可以和放疗及曲妥珠单抗治疗同时应用。
乳腺癌术后辅助曲妥珠单抗治疗适应症:
原发浸润灶大于1.0 cm HER-2阳性时,推荐使用曲妥珠单抗;原发肿瘤在0.5~1.0 cm时,可考虑使用。中国专家团认为对直径不超过0.5 cm的浸润性HER-2阳性肿瘤,曲妥珠单抗的选择应综合考虑,如对于HER-2阳性T1aN0乳腺癌,如果原发癌ER阴性且肿瘤大小接近 5 mm,可以考虑每周紫杉醇+曲妥珠单抗辅助治疗;淋巴结微转移的患者也应考虑曲妥珠单抗治疗。对于ER阳性乳腺癌且肿瘤大小接近 1 mm的患者,当估计复发风险小于5%且可以选择内分泌治疗时,辅助全身化疗 抗HER-2的绝对获益非常微弱。
相对禁忌证:
⑴ 治疗前LVEF<50%。
⑵ 同期正在进行蒽环类药物化疗。
放疗的适应证:
全乳切除术后,具有下列预后因素之一,则符合高危复发,具有术后放疗指征,该放疗指征与全乳切除的具体术式无关:
⑴ 原发肿瘤最大直径大于等于5 cm,或肿瘤侵及乳腺皮肤、胸壁。
⑵ 腋窝淋巴结转移大于等于4枚。
⑶ 淋巴结转移1~3枚的T1-2,目前的资料也支持术后放疗的价值,然而对低危亚组需权衡放疗获益和风险。术后放疗可能在包含以下因素的患者中更有意义:年龄小于等于40岁,腋窝淋巴结清扫数目小于10枚时转移比例大于20%,激素受体阴性,HER-2过表达,组织学分级高,以及脉管阳性等。
⑷ T1-2乳腺单纯切除术,如SLN阳性,当不考虑后续腋窝清扫时,推荐术后放疗;如不考虑放疗,则推荐进一步腋窝清扫。
乳腺癌的治疗相对复杂,具体治疗方案需在有经验的医疗机构制定个体化方案。
- 上一条:急性胰腺炎
- 下一条:什么是腹腔热灌注化疗
- 别再跟脂肪“死磕”了!外科减重:不是“切胃作弊”,而是给身体“重启健康” 2025-11-30
- 乳腺包块别慌:揭开它的“真面目” 2025-10-31
- 你相信光吗 2025-09-30
- 不容忽视的“肠道交通堵塞” 2025-08-31
- 小小阑尾,不可忽视-阑尾炎 2025-07-31











